
El comportamiento homosexual y sus bases neurales
Genaro A. Coria-Avila*, Rodrigo Triana-Del Rio, Jorge Manzo
Programa de Neurobiología, Universidad Veracruzana, Xalapa,
Ver., México.
Resumen
Objetivo: Redefinir el concepto de comportamiento
homosexual analizando sus bases apetitivas, precopulatorias, consumatorias y
posconsumatorias; así como analizar las bases neurales y el papel del
aprendizaje en el comportamiento homosexual. Desarrollo: Proponemos un
continuum comportamental con el cual los humanos y animales muestran
comportamientos homosexuales de expresión y duración variable. Se discute el
papel del dimorfismo sexual del cerebro y la evidencia que lo correlaciona con
el comportamiento y las preferencias sexuales. También se muestra evidencia
reciente que sugiere que a través del condicionamiento, los animales pueden
desplegar preferencias que pasan de lo social a lo homosexual de manera
temporal si pasaron suficiente tiempo junto a la pareja del mismo sexo, bajo la
influencia de agonistas para el receptor de dopamina tipo D2. Conclusión: la
discusión en este artículo sugiere que el comportamiento homosexual puede
ocurrir de manera sutil o explícita, temporal o permanentemente, dependiendo
del cálculo que resulta de la actividad de neurocircuitos organizados por
hormonas en periodos perinatales junto con aquellos circuitos organizados por
el aprendizaje en periodos posteriores.
Objective: Redefine the concept of homosexual
behavior and its neural bases, and to discuss the role of conditioning on
learnt homosexual behaviors. Development: We propose a behavioral continuum in
which animals and humans may display appetitive, precopulatory, consummatory or
postconsummatory homosexual behaviors with variable intensity and duration. We
discuss the role of brain dimorphism on sexual behavior and partner preference.
In addition, we show evidence indicating that animals may display learnt social
preferences that switch into homosexual preferences if they spent sufficient
time of cohabitation with an individual of the same sex under the effect of
dopamine type D2 agonists. Conclusion: The evidence in this article suggests
that homosexual behavior may be subtle or explicit, transitory or long-lasting,
as a result of the computation that results from the activity of
neurocircuitries organized by hormones during perinatal periods and by learning
during later periods of life.
Keywords: Learning, Conditioning, Dopamine,
Homosexuality, Partner preference, Quinpirole.
Según la teoría de la selección
natural propuesta por Darwin hace 152 años, la naturaleza favorece la
variabilidad dentro de las especies, de forma tal que las presiones del medio
benefician a los individuos con características convenientes a las
circunstancias de un tiempo y espacio determinados.1 En esa misma teoría, la selección sexual
sugiere que las especies con reproducción sexual poseen atributos que les
auxilian en la competencia intra e intersexual para la adecuación reproductiva
y propone que los individuos con características desfavorables mueren sin
llegar a reproducirse, con lo cual los atributos no deseados se eliminan
eventualmente de la especie. Sin embargo, al estudiar la conducta sexual en
humanos y animales descubrimos patrones interesantes que sugieren que la
competencia sexual no siempre es con el fin de lograr la reproducción.
El sexo puede
ocurrir cuando se alcanzan niveles suficientes de motivación para conseguir una
recompensa sexual, o cuando hay predicción de ésta a través de estímulos
condicionados; lo cual lleva a los individuos a tomar decisiones basadas en el
valor incentivo de los estímulos en la pareja. Esto se confirma al observar que
en humanos y en animales no todos los machos compiten por hembras, ni todas las
hembras compiten por machos. De hecho, pareciera que en cada población animal
existe una proporción constante de individuos con preferencia de pareja hacia
individuos del mismo sexo, es decir, que muestran comportamiento homosexual.2 Por ejemplo, diferentes tipos de aves,
mamíferos acuáticos, ungulados, y mamíferos terrestres incluyendo primates.3 Obviamente, individuos que
solo despliegan comportamiento homosexual no se reproducen, pero eso no
significa que sean infértiles. Por lo tanto, uno pudiera preguntarse hasta qué
punto la selección sexual juega un papel en el comportamiento homosexual.
¿Acaso la naturaleza selecciona individuos que no quieren aparearse con el sexo
opuesto? o ¿acaso la preferencia homosexual es algo aprendido independiente a
la selección?
Los estudios
en animales han aportado información relevante para el entendimiento del
cerebro en general y de cómo se forman las bases neurales de la preferencia de
pareja. Ésta es el resultado de la actividad de circuitos cerebrales
involucrados en diversas tareas como la motivación sexual, la recompensa, la
predicción de estímulos condicionados, y en la toma de decisiones basada en el
valor incentivo de los estímulos en la pareja (ver revisión en 4, 5). Se sabe además, que los
circuitos cerebrales que modulan nuestra preferencia de pareja no son fijos e
inflexibles; sino que pueden modificarse críticamente durante ciertos periodos
perinatales cuando las hormonas fluctúan, y también a lo largo de la vida
mediante la experiencia.
El
primer objetivo de este artículo es redefinir el concepto de comportamiento
homosexual de acuerdo a la clasificación de comportamiento sexual actual.
Después, utilizando evidencia experimental obtenida tanto de animales como de
humanos discutiremos las bases neurales del comportamiento homosexual. Con esta
revisión esperamos convencer al lector de que la expresión de comportamiento
homosexual puede ser muy sutil o explícita, lo cual depende de que exista
motivación sexual hacia un individuo del mismo sexo. Dicha motivación puede ser
temporal o permanente y ocurre como resultado de la combinación de actividad de
circuitos nerviosos formados en el periodo perinatal, y aquellos circuitos
formados por el aprendizaje en periodos posteriores.
Redefiniendo el
Comportamiento Homosexual
El comportamiento
homosexual ocurre en la naturaleza más veces de las que nos damos cuenta, y
menos veces de las que creemos observarlo. Este puede definirse a partir del
comportamiento sexual, el cual ocurre como movimientos, pausas y posturas,
orientadas directamente hacia la interacción sexual con un individuo, o
indirectamente cuando estímulos no sexuales han ganado un valor sexual a través
del condicionamiento; y por lo tanto producen un estado de motivación sexual.
Así, en un contexto puramente evolutivo la interacción sexual se enfoca en el
apareamiento y la reproducción, pero analizado desde un contexto neurobiológico
se desglosa en lo que ocurre antes, durante y después de la cópula; abarcando
las fases apetitivas, precopulatorias, copulatorias o consumatorias y
poscopulatorias, lo cual permite evaluar algunas de las bases emocionales del
sexo.6-8
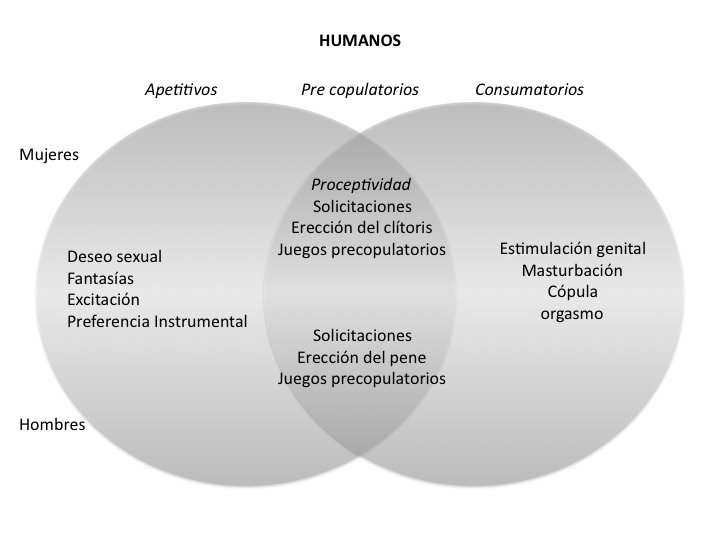
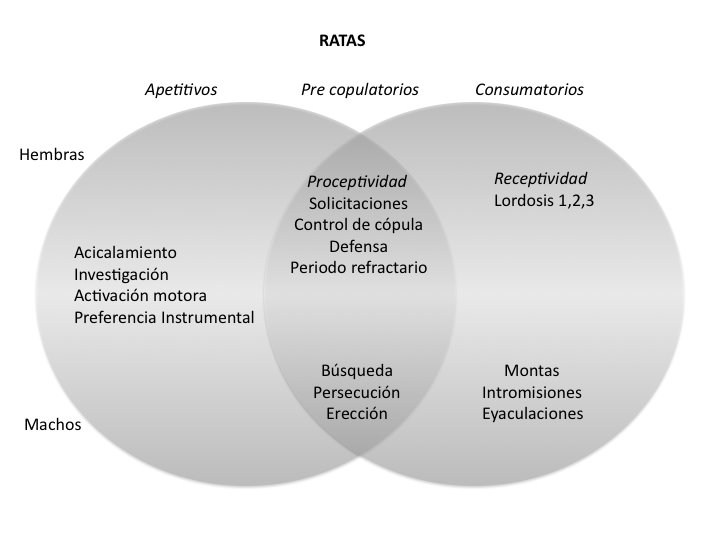
Figura. 1. Clasificación del comportamiento sexual. Modificado
de Pfaus 1996; Pfaus et al., 2001, 2003. Cuando éste es dirigido a un individuo
del mismo sexo en cualquiera de sus fases apetitivas, precopulatorias o
consumatorias debe considerarse comportamiento homosexual.
En la
fase apetitiva, humanos y animales despliegan comportamientos que
indican un estado fisiológico de excitación aunque estén en ausencia de una
pareja. Las ratas, por ejemplo, se acicalan más y tienen locomoción
incrementada. El “apetito” sexual también se observa en la preferencia por el
olor dejado por una pareja potencial y la búsqueda de ésta junto con respuestas
instrumentales que indican la motivación para tener acceso a ella (apretar una
palanca cientos de veces, subir rampas, cruzar obstáculos, etc.). En los
humanos, esta fase de motivación se caracteriza por la fantasía sexual, pero
también ocurre un incremento de la actividad motora y respuestas instrumentales
que indican la motivación para tener acceso sexual a la pareja (darle regalos,
escribirle cartas, viajar grandes distancias para verle).
La
fase precopulatoria ocurre en presencia de la pareja potencial. Las
ratas macho, por ejemplo, persiguen a la hembra y prefieren su contacto sobre
el de otros individuos. También se observan respuestas fisiológicas que
preparan al animal para la cópula, como las erecciones. Las hembras muestran
comportamientos denominados “proceptivos” invitando al macho a consumar el
apareamiento (pequeños saltos, movimientos rápidos de orejas, carreras cortas).
En los humanos esta fase comienza desde el coqueteo con manos, gestos y
posturas; y continúa con el juego precopulatorio en el cual se distingue la
erección del pene o clítoris.
En la
fase copulatoria ocurre el contacto de genitales. En las ratas el
macho monta a la hembra, y la intromite; mientras que ella responde con
lordosis, facilitando las intromisiones. En los humanos, esta fase se limita a
la imaginación de la pareja, pero al igual que en las ratas culmina en una
eyaculación. Esta última marca el final de la serie copulatoria del macho a
través de un periodo refractario de inactividad poscopulatoria, en la
cual ocurren cascadas neuroendocrinas que consolidan el aprendizaje y vínculos
de pareja. En las hembras, la fase copulatoria parece no tener un
comportamiento específico que indique que ha finalizado, pero se sabe que entre
más intenso es el estímulo sexual que recibe la hembra, más se acelera la
terminación del estro.
En un
análisis estricto, cualquier comportamiento apetitivo, precopulatorio,
copulatorio o poscopulatorio dirigido hacia individuos del mismo sexo debe
clasificarse como comportamiento homosexual. Por ejemplo, una rata macho que
aprieta una palanca para obtener acceso a un macho más veces que la palanca de
acceso a una hembra, puede ser análogo de un hombre dando flores a otro hombre
en vez de darlas a una mujer (respuesta instrumental). Ese comportamiento
refleja un nivel apetitivo del comportamiento y pudiera indicar motivación
homosexual, sobre todo si la preferencia es recurrente. Sin embargo, una rata
hembra que monta a otra hembra puede ser análogo de dos mujeres bailando juntas
sensualmente para ganar la atención de los varones, y no necesariamente
preferencia homosexual; sobre todo si el interés por la hembra siempre ocurre
antes del encuentro con el macho. Por lo tanto, la recurrencia y consecuencias
del comportamiento son importantes para poder clasificar el comportamiento como
homosexual.
El
continuum comportamental
Debido a la variabilidad
de comportamiento sexual clasificable como homosexual sugerimos que este puede
organizarse en un “continuum” con una escala del 0 al 7 (Figura 2), y
que usamos aquí para esquematizar grados del comportamiento homosexual.
En el continuum la intensidad del comportamiento aumenta en un sentido ApetitivoÞConsumatorio y junto con la
frecuencia o duración del mismo indican un punto aproximado de clasificación.
El eje X muestra en su extremo izquierdo el valor 0 en la zona más clara, el
cual indicaría la ausencia de cualquier comportamiento clasificable como
homosexual. Los valores 1 al 3 indicarían aquellos comportamientos más sutiles,
que a pesar de ser catalogados como homosexuales pueden desplegarse en
contextos cuyo fin no es la cópula. Ejemplo del nivel 1 es la preferencia
sensorial por un individuo (verle, olerle, escucharle, etc.). En el nivel 2
encontraríamos la elección del individuo para visitarle primero a pesar de
tener otras opciones para visitar. En el nivel 3 estarían las preferencias por
compartir el mismo espacio, a pesar de tener la opción de compartirlo con el
sexo opuesto. A partir del nivel 4 se encontrarían comportamientos que indican
la fase apetitiva del comportamiento sexual, como las respuestas instrumentales
y el contacto físico, y en los humanos encontraríamos además las fantasías
sexuales. El nivel 5 consistiría en comportamientos de cortejo dirigidos al
mismo sexo, y en el nivel 6 estaría la cópula explicita, en la cual hay
contacto genital. En el nivel 7 encontraríamos la formación de vínculos
afectivos de pareja de larga duración dirigidos hacia un individuo del mismo
sexo. Ningún nivel en la escala tiene que ser fijo e inflexible. Por lo tanto,
el eje Y indica la frecuencia y/o duración de cada evento, de tal forma que un
individuo puede pasar una o varias veces por un nivel, y estar temporalmente
clasificado en la escala. Por ejemplo, una hembra que monta a otra hembra para
llamar la atención del macho está desplegando comportamiento homosexual en un
nivel 5 de nuestra escala, pero únicamente por periodos cortos. Si un
comportamiento es frecuente o tiene larga duración sube la intensidad del color
de la escala, pudiendo alcanzar similitudes con comportamientos con valores más
altos. Por ejemplo, un individuo que de manera constante y recurrente
experimenta fantasías sexuales con individuos del mismo sexo (punto más oscuro
del nivel 4) pero nunca alcanza niveles más altos en el comportamiento, pudiera
considerarse en la misma escala homosexual que un individuo que ha llegado a
cortejar individuos del mismo sexo (punto intermedio del nivel 5), o incluso
podría ser comparable en la escala con individuos que aunque sea en una ocasión
han llegado a tener contacto genital homosexual (punto más bajo del nivel 6).
Hemos considerado que en el nivel más alto deben estar los comportamientos que
indiquen vínculos afectivos de pareja, ya que estos pueden ser consecuencia de
la cópula4 e infieren una preferencia
de duración más larga. La idea de un continuum surge de propuestas previas como las de Terman y Miles9 o Kinsey et al.,10 Sin embargo, a diferencia de
ellos, nuestra propuesta no se enfoca ni en la proporción de
masculinidad-feminidad o de homosexualidad de un individuo, respectivamente; sino que
hacemos énfasis en un “continuum de comportamiento sexual”
abarcando fases apetitivas y consumatorias. Este continuum permite clasificar el comportamiento en niveles de
acuerdo a su intensidad y frecuencia, pudiendo ser dirigido hacia individuos
del mismo sexo con expresiones sutiles, o explícitamente homosexuales. En
general, nuestro continuum sugiere que el comportamiento
homosexual se presenta más conmúnmente de lo que creemos, y que los datos que
existen en la literatura han sido sub-reportados. Por ejemplo, en el libro “The
sexual behaviour of the human male” Kinsey10 reportó que aproximadamente el 37%
de los varones adultos de esa época tuvieron algún tipo de experiencia
homosexual hasta el punto de orgasmo (nivel 6 en nuestra escala). De acuerdo a
ese reporte, Kinsey descartó individuos cuya experiencia homosexual hubiera
ocurrido antes de la adolescencia o aquellas experiencias en las que no ocurrió
orgasmo, lo cual significa que grados sutiles de comportamiento homosexual ni
siquiera fueron considerados (comportamientos de 5 o menos en nuestra escala).
Otras encuestas de las últimas décadas11 reportaron que entre
1988-1990, al menos un 20% de los hombres adultos de Estados Unidos habían
tenido en algún momento de su vida una experiencia homosexual, pero los datos
de comportamientos sutiles que pudieran indicar una motivación tampoco fueron
reportados. De hecho, en un trabajo reciente, Paul et al.,12 reportaron que hombres catalogados
como heterosexuales (nivel 0 ó 1 en la escala de Kinsey) expresaron grados
sutiles de motivación sexual al observar videos de sexo homosexual. Por lo
tanto, el contiuum comportamental es una manera
objetiva de catalogar el comportamiento homosexual, con lo que se refuerza la
idea original de Kinsey referente a que el comportamiento sexual no ocurre en
un patrón inflexible donde solo existe la dicotomía “heterosexual-homosexual”,
sino que existen diferentes niveles de expresión. Creemos que los distintos
niveles comportamentales pudieran reflejar distinta organización cerebral ya
sea innata o consecuencia del aprendizaje.
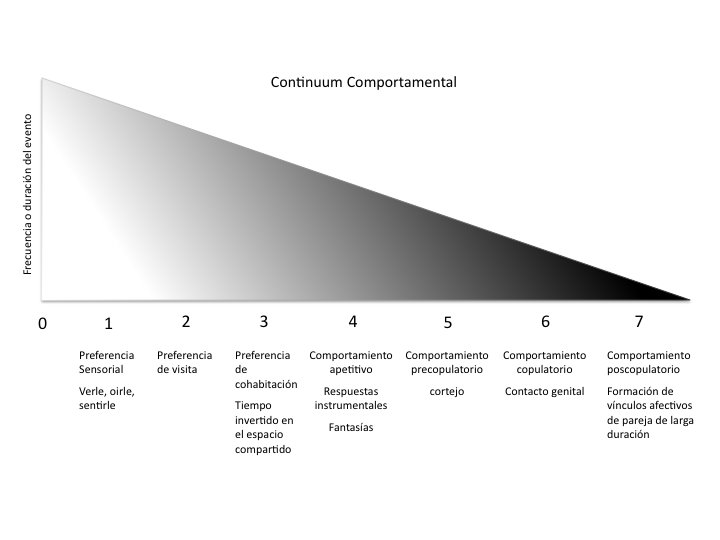
Figura. 2. Nuestro continuum sugiere que los humanos y animales
muestran comportamientos homosexuales apetitivos, precopulatorios,
consumatorios y posconsumatorios. Estos pueden expresarse de manera sutil
(nivel 1) o explícita (niveles superiores), o de manera temporal o permanente
(escala de grises indica la frecuencia o intensidad). Para explicación completa
ver descripción en texto.
La organización del
cerebro sexual
Desde hace varias décadas se sabe
que el cerebro adulto tiene estructuras sexualmente dimórficas, es decir,
agrupaciones de neuronas cuyo volumen o tamaño es diferente entre machos y
hembras. Una de las primeras estructuras reportadas fue el Núcleo Sexualmente
Dimórfico del Área Preóptica NSD-APO.13 Este es mayor en los machos porque
contiene más neuronas que sobreviven gracias a la acción de la testosterona (T)
producida por los testículos en el periodo perinatal. En ausencia de testículos
no hay suficiente T y algunas de las neuronas sensibles al dimorfismo sufren
apoptosis, dejando un volumen celular menor al original. Se sabe, por ejemplo,
que ratas castradas perinatalmente no tienen diferencias en el volumen del
NSD-APO al compararlos en la adultez con hembras.14 Por lo tanto, en condiciones
naturales, la ausencia de testículos conlleva a la formación de un NSD-APO
femenino. Si los machos castrados o hembras intactas reciben tratamiento con T
exógena perinatalmente conservan vivas a la mayoría de las células, formándose
un NSD-APO de mayor tamaño típicamente masculino.15 Este efecto
organizacional depende de periodos críticos de sensibilidad a la T, pues
castraciones o inyecciones de T posteriores al día 29 dejan de afectar el
dimorfismo.14 Los machos castrados al momento
de nacer no muestran interés por las hembras cuando son adultos, es decir,
experimentan un proceso de desmasculinización. Además, machos adultos
desmasculinizados tratados con estradiol (E) pueden desplegar comportamiento
consumatorio femenino de lordosis si reciben estimulación de los flancos por
otro macho. Es decir, con ayuda hormonal pueden experimentar un proceso de feminización.
De manera similar, hembras que han sido tratadas con T (o su metabolito E) en
edad temprana, tienen un dimorfismo cerebral similar a los machos y dejan de
hacer lordosis y pueden experimentar esterilidad anovulatoria (desfeminización).
Además, si hembras desfeminizadas son tratada con T en la edad adulta pueden
desplegar comportamientos consumatorios masculinos (montas) en presencia de una
hembra sexualmente receptiva; es decir, experimentan masculinización
de su comportamiento. Esto demuestra que la T a través de su metabolito E tiene
efectos organizacionales sobre el cerebro únicamente en periodos tempranos de
vida y efectos activadores en la pubertad y edad adulta.
Hay al menos
una decena más de estructuras cuyo volumen es mayor en el macho, incluyendo los
circuitos olfatorios principal y accesorio, núcleos del hipotálamo anterior
(preóptico, NSD-APO, supraóptico, ventromedial), y núcleos de la médula espinal
(espinal del bulbo cavernoso) que inervan músculos del pene. Las hembras, por
su parte, tienen estructuras cuyo volumen es mayor, incluyendo el cuerpo
calloso, núcleos del hipotálamo (periventricular anteroventral) y del tallo
cerebral (Locus coeruleus).16 Otras características del dimorfismo
sexual cerebral se aprecian al contar el número de sinapsis y espinas
dendríticas.17 En conjunto, pareciera que
el dimorfismo sexual observado en roedores correlaciona con la capacidad de
desplegar comportamientos masculinos o femeninos, aunque se sabe que la
incongruencia de los núcleos sexualmente dimórficos cerebrales en humanos no
indica homosexualidad,18 es decir no son la causa última de la
homosexualidad.
Dimorfismo sexual cerebral
y homosexualidad en humanos
De acuerdo a
LeVay,18 parte del hipotálamo anterior de los
hombres homosexuales tiene la forma anatómica típica de las mujeres. En su
estudio, el núcleo intersticial 3 del hipotálamo anterior (INAH 3), que es
mayor en hombres que mujeres, tenía el doble de tamaño en hombres
heterosexuales que en hombres homosexuales. Con esto se llegó a proponer que
los homosexuales y heterosexuales difieren en los mecanismos neuronales que
regulan la conducta sexual. Sin embargo, una crítica a este estudio fue el uso
de cerebros de hombres catalogados homosexuales al haber muerto a causa del
virus VIH/SIDA por contagio homosexual. Asimismo se catalogó por eliminación a
la otra población masculina como heterosexual, sin conocer previamente su
conducta. Dada la posibilidad de que la presencia del virus destruyera cuerpos
neuronales, se criticó la posibilidad de un error en el cálculo del tamaño del
INAH3 de los homosexuales.19 De cualquier forma, los datos
muestran correlaciones, no causalidad. Es tan probable que la conducta pueda
afectar la densidad neuronal de una región del cerebro, como que la densidad
neuronal regional pueda afectar a la conducta. Es decir, se desconoce si el
dimorfismo sexual observado en el INAH 3 es una causa de la homosexualidad o el
resultado de ella. En estudios similares y contemporaneos también se reportó la
presencia de otras estructuras dimórficas como la comisura anterior, pero no se
replicaron hallazgos del INAH3.20, 21 En el mejor de los casos,
los datos de LeVay sugieren que de manera general el hipotálamo de los humanos
también es sexualmente dimórfico.
Existen otros datos obtenidos por tomografías por emisión de positrones
(PET-CT), indicando que la actividad cerebral de hombres homosexuales y
heterosexuales es diferente en el hipotálamo anterior cuando son expuestos a
sudor masculino u orina femenina. En estas secreciones se encuentra el derivado
de testosterona 4,16-androstadieno-3 (AND) y el esteroide similar al estradiol
estra-1,3,5 (10),16-tetraenol (EST), respectivamente; los cuales se han
considerado candidatos a ser feromonas humanas. De acuerdo a Savic, Berglund y
Lindstrom,22 hombres homosexuales y mujeres
heterosexuales tuvieron mayor actividad en el área preóptica media (APOM) al
ser expuestos al AND, mientras que los hombres heterosexuales respondieron más
al EST. El APOM es adyacente al hipotálamo anterior y funge como centro
integrador de estímulos naturales y condicionados asociados con sexo por lo que
se considera como el “epicentro” de la motivación sexual.23 Con los datos de Savic y
colaboradores no se puede saber si el APOM de hombres homosexuales es
anatómicamente más parecido al de mujeres heterosexuales, pero se argumenta que
al igual que el APOM de ellas, respondió más a un estímulo másculino olfativo.
Por lo tanto, queda la duda si dicha actividad neural es el resultado de una organización
neuronal perinatal, o si es resultado del aprendizaje en la edad adulta.
Otros autores
también han obtenido datos por resonancia magnética funcional (fMRI), para
evaluar la activación cerebral en hombres homosexuales y heterosexuales. De
acuerdo a Hu et al.,24 la exposición a imágenes eróticas
activó en ambos grupos áreas comunes como el giro prefrontal medial, los lóbulos
temporales, el giro post central, el tálamo, la ínsula, el vérmis cerebelar, el
precuneus izquierdo, la corteza occipital y la parietal. Es decir, áreas
involucradas en la integración de la visión como el tálamo, y su procesamiento
hacia la ínsula y otras cortezas como la visual y lóbulos temporales de
asociación con memoria, principalmente episódica. En hombres homosexuales se
activó principalmente el giro angular izquierdo de la corteza parietal, el
núcleo caudado izquierdo, y el pálido derecho. Los hombres heterosexuales
mostraron activación bilateral del giro lingual de la corteza occipital, el
hipocampo derecho, y el giro parahipocampal derecho. En el estudio de Hu et
al., 24 áreas del hipotálamo anterior como el
INAH 3, o APOM involucradas en el dimorfismo sexual no mostraron activación
diferente cuando los voluntarios eran expuestos a imágenes eróticas generales.
Sin embargo, en otro estudio reciente Paul et al.,12 evaluaron con fMRI el cerebro de
hombres heterosexuales y homosexuales mientras observaban videos de sexo
explícitamente heterosexual u homosexual. Sus datos mostraron que el hipotálamo
de hombres heterosexuales u homosexuales se activaba únicamente con videos
correspondientes a la orientación sexual que los voluntarios reportaron, lo
cual indica que independientemente de la orientación sexual el hipotálamo es el
centro integrador de la motivación sexual. Sin embargo, los videos
correspondientes a la orientacion sexual reportada siempre produjeron más
actividad en los hombres heterosexuales, lo cual pudiera corresponder al
dimorfismo sexual previamente reportado por LeVay.18 Es decir, de haber más neuronas en un
hipotálamo heterosexual masculino, la fMRI captaría más actividad.25 La actividad del hipotálamo, amígdala y
núcleo accumbens con estímulos sexuales preferidos de acuerdo a la orientación
sexual también se confirmó en el trabajo de Safron et al..26
Con el experimento
de Paul et al.,12 se logró entender cuáles son las
áreas generales y específicas activadas por videos correspondientes a la orientación
sexual reportada por los voluntarios, pero también por videos de sexo contrario
a la orientación sexual reportada. Las áreas generales incluían activación
bilateral de áreas occipito-parieto-temporales, hipotálamo y hemisferios
cerebelares. Al observar sexo heterosexual, los hombres heterosexuales tenían
mayor actividad en áreas como el giro cingulado anterior derecho, el giro
cingulado rostral izquierdo, el núcleo caudado derecho, la ínsula derecha, el
giro frontal superior derecho, el giro frontal medial izquierdo, y el
mesencéfalo derecho; es decir, activación unilateral de áreas relacionadas con
la formación de emociones, procesamiento de información y aprendizaje. Los
homosexuales observando videos de sexo homosexual presentaban además de las áreas
generales, activación del giro frontal medial derecho y del giro frontal
inferior izquierdo. Sin embargo, con videos sexuales contrarios a la
orientación sexual, tanto heterosexuales como homosexuales mostraron incremento
de actividad bilateral en la ínsula, lo cual sugiere la presencia de estímulos
aversivos indicadores de desaprobación o disgusto.27 De manera particular los
heterosexuales mostraron actividad en núcleo caudado y amígdala derecha,
mientras que los homosexuales tuvieron más en núcleo caudado izquierdo.
Basado en las
diferencias de actividad neuronal, Ponseti et al.,28 también han sugerido el uso de
fMRI como una herramienta para identificar la orientación sexual a través de la
presentación de imágenes homosexuales o heterosexuales a los individuos. De
acuerdo a su evidencia y la de otros mencionados anteriormente, es probable que
la orientación sexual en humanos dependa del grado de motivación sexual basal
que resulta de la actividad del mesencéfalo e hipotálamo y de la actividad
neural adicional de las cortezas asociativas, probablemente producto del
aprendizaje. Consequentemente, la actividad hipotálamica que se observa por
exposición a feromonas EST y AND pudiera indicar grados de motivación sexual
subconsciente, dependiente de circuitos formados perinatalmente,22 mientras que las cortezas asociativas
pudieran indicar preferencias aprendidas. El hipotálamo y la amígdala pueden
responder de manera inconsciente a estímulos olfativos o visuales sexualmente
relevantes, y una vez activados pudieran orquestar junto con las cortezas
asociativas, motoras y cerebelo, la motivación y comportamiento lógico.25 Por ejemplo, la información
visual sexualmente relevante pasaría directamente de retina hacia nervios
ópticos, integrarse en tálamo (núcleo lateral geniculado), culliculus
superiores, núcleo pulvinar, amígdala,26, 29 e hipotálamo. Mientras que la
información olfativa tiene acceso directo del bulbo olfativo accesorio a la
amígdala vomeronasal y al hipotálamo30 (Figura 3).
Debe hacerse
énfasis en que los voluntarios de los experimentos anteriores se declararon
homosexuales o heterosexuales al momento de los estudios. Por lo tanto, la
actividad neural reportada pudiera reflejar la presencia de circuitos
sexualmente dimórficos desde una edad temprana (mayormente concentrados en el
hipotálamo y mesencéfalo), o bien circuitos que a través del aprendizaje se
hicieron sexualmente dimórficos (probablemente repartidos en las cortezas
asociativas). Además, el aprendizaje que ocurre en un individuo adulto a través
de las vivencias únicas a las que se enfrenta pudiera modificar la actividad (y
quizá la forma) de núcleos sexualmente dimórficos formados en edades tempranas.
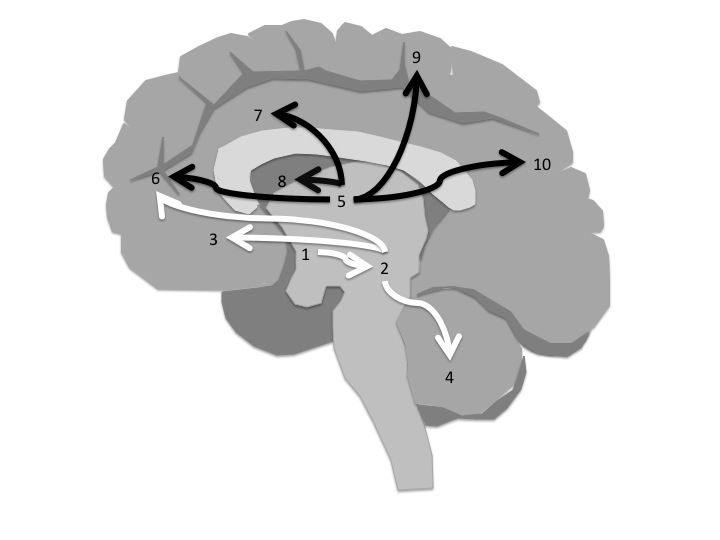
Figura. 3. Muestra el circuito
hipotético de la motivación sexual dependiente de neurocircuitos innatos
formados en periodos perinatales del desarrollo (flechas blancas) y la
motivación dependiente de neurocircuitos formados por el aprendizaje en
periodos posteriores (flechas negras). 1) El hipotálamo se activa en
heterosexuales y homosexuales, preferentemente con estímulos correspondientes a
la orientación sexual. 2) el mesencéfalo contiene neuronas dopaminérgicas que
pueden responder a la actividad hipotalámica. 3) el núcleo accumbens se activa
por estimulación del mesencéfalo y contiene receptores de dopamina,
especialmente los de tipo D2, involucrados en la formación de preferencias de
pareja. 4) el cerebelo también recibe información del mesencéfalo y se activa
durante la excitación sexual. 5) el tálamo recibe información sensorial
sexualmente relevante y la proyecta hacia cortezas asociativas como la 6)
frontal, 7) cíngulo, 8) insular, 9) giro poscentral y 10) precuneo (parietal).
El aprendizaje en
la preferencia de pareja
Los circuitos nerviosos
organizados en el periodo perinatal modulan parte de la motivación sexual y los
aspectos apetitivos del comportamiento, como la atracción de un macho por el
olor de una hembra en estro cuando son adultos. Sin embargo, las preferencias
por una pareja dependen también del condicionamiento, asociando recompensas o
aversiones con ciertos estímulos condicionados (ver revisión en 4,
5). Se ha mostrado que una
rata macho puede preferir a una de dos hembras cuando la asocia con eyaculación
a través de olores artificiales como el extracto de almendra,31 y que una hembra puede
preferir a uno de dos machos a través del mismo olor asociado con recompensa
sexual.32, 33 Este proceso requiere
plasticidad cerebral y conexiones nuevas para que el olor a almendra pase de
ser un estímulo neutral a un estímulo con incentivo sexual y dirija la atención
y motivación hacia la pareja que lo tiene. En roedores monógamos (Microtus
ochrogaster) el sexo o la cohabitación por 24 hrs facilitan la formación
de preferencia por esa pareja, a pesar de tener otras opciones para aparearse.34 Es decir, sexo y cohabitación
facilitan la plasticidad cerebral suficiente para que la preferencia por las
características de la pareja se consoliden y produzcan suficiente motivación
para preferirle por encima de otras parejas. Periodos menores a 24 hrs no
producen la formación de preferencias, lo cual sugiere que se necesita de un
tiempo suficiente para consolidar memorias emocionales relacionadas con el
deseo sexual hacia una pareja en particular. Sin embargo, en los mismos
roedores el tratamiento con agonistas de oxitocina35 o dopamina para el receptor
tipo D236 producen una aceleración en
la formación de preferencias de pareja, a pesar de cohabitar por periodos
cortos o en ausencia de sexo.
Datos
recientes de nuestro laboratorio indican que, en ratas, el aprendizaje a través
del condicionamiento puede inducir una preferencia homosexual en machos adultos
que cohabitan con otros machos bajo la influencia de un agonista dopaminérgico
para el receptor D2 como el quinpirole. Es decir, que la activación de
circuitos neurales que contienen receptores D2 y la cohabitación concomitante
acelera la plasticidad cerebral para facilitar comportamientos apetitivos,
precopulatorios e incluso copulatorios entre dos individuos del mismo sexo. En
dicho estudio,37, 38 un grupo de ratas macho
inexpertas sexualmente, fueron tratadas con 1.25 mg/kg de quinpirole y fueron
puestas a cohabitar por 3 periodos intermitentes de 24 hrs con otro macho cuya
espalda, cuello y genitales fueron impregnados con extracto de almendra como
estímulo condicionado. El grupo control recibió una inyección del vehículo y el
mismo procedimiento de condicionamiento. En una prueba final 4 días después del
último condicionamiento los animales estuvieron libres de fármacos y fueron
sometidos a una prueba de preferencia de pareja utilizando una arena de tres
compartimentos. En un compartimento se colocó el macho con olor con el que se
cohabitó previamente y en el compartimento opuesto a un macho nuevo, sin olor.
Ambos machos permanecieron en su respectiva caja a través de una pechera atada
a uno de los extremos. El macho experimental permaneció libre para visitar a
los dos machos estímulo. Los datos se analizaron de acuerdo al continuum
comportamental (Figura 2) y se encontró que el grupo tratado con quinpirole
olfateó más al macho con olor (nivel 1), visitó más al macho con olor (nivel
2), tuvo más episodios de juego juntos y permanecieron más tiempo cuerpo
a cuerpo (nivel 3), lo cual indicó una preferencia social condicionada. Sin
embargo, en un segundo experimento casi idéntico, los machos estímulo de los
compartimentos laterales fueron sexualmente expertos. En la prueba final, solo
el grupo tratado con quinpirole, olfateó más al macho con olor (nivel 1),
desplegó más visitas por el macho con olor (nivel 2), tuvo más episodios de
juego, más contacto cuerpo a cuerpo (nivel 3), hizo más intentos de monta
hacia el macho compañero (nivel 4), recibió más intentos de monta por su
compañero, e incluso mostró comportamientos de proceptividad como brincos y
carreras cortas similares a los de una hembra proceptiva (nivel 4 y 5), lo cual
no ocurrió en el grupo control.37, 38 Esto indicó que la
expresión de comportamiento homosexual no solo dependía del aprendizaje de los
machos experimentales (quinpirole vs. salina), sino también de las condiciones
de su compañero (en este caso expertos sexualmente). En un experimento similar
más reciente se reportó que machos experimentales tratados con quinpirole
tienen más erecciones psicogénicas (las que ocurren sin contacto) si se colocan
en un lado de una caja dividida por la mitad por una reja que permite la
olfación, visión y la audición del macho estímulo presente en el otro lado.38, 39 Las erecciones también
representan comportamiento precopulatorio y un nivel 4 en la escala del
continuum comportamental, e indican un grado de excitación sexual que no se
observó en los animales tratados con solución salina. Puestos en conjunto,
estos datos indican que los animales tratados con quinpirole estuvieron más
excitados (observado con erecciones) y más motivados (observado con el
comportamiento homosexual) al momento de estar frente a su compañero macho.
Se ha reportado que es el núcleo
accumbens shell (concha) donde los receptores dopaminérgicos tipo D2 son
necesarios para la formación de preferencia de pareja.40 Por lo tanto, es posible que
en ratas macho la activación de dichos receptores en presencia de otro macho
sea “necesario y suficiente” para producir estados fisiológicos que facilitan
el aprendizaje y la motivación para producir comportamientos homosexuales
posteriores.37 Sin embargo, más datos
recientes de nuestro laboratorio39 indican que el olor condicionado
produce también actividad del APOM, área ventral tegmental, hipotálamo, corteza
piriforme, y corteza del cíngulo anterior, observado con la expresión de la
proteina Fos. Es decir, las áreas relacionadas con la integración de
información olfativa y motivación sexual en la rata. En humanos, la exposición
a estímulos sexualmente relevantes (olores e imágenes) también pareciera
producir actividad en dos tipos de neurocircuitos. Por un lado, aquellos a los
que se les atribuye dimorfismo sexual formado perinatalmente, y por otro lado,
aquellos circuitos que resultan del aprendizaje de experiencias vividas,
principalmente encontrados en las cortezas asociativas. En conjunto, la
actividad paralela sería necesaria para hacer un cálculo neural de los sistemas
cognitivo-afectivo, y sensorial-motor que resulte en excitación sexual,
motivación, incremento de atención y por lo tanto comportamiento homosexual.12, 26
¿Pudiera el
comportamiento homosexual aprenderse en los humanos?
Existen datos como los de de
los hermanos Bruce y Brian Reimer que concuerdan con la idea de que la identidad
de género y motivación sexual de un individuo no dependen únicamente del
contexto cultural en que es criado,41 sino también de
circuitos neurales organizados dimórficamente en la edad perinatal. Sin
embargo, como nuestros datos en ratas lo sugieren, la activación de receptores
D2 junto con el tiempo de cohabitación suficiente pueden generar preferencia
homosexual dependiendo de la experiencia sexual previa de los individuos y de
sus expectativas durante la prueba. Esto sirve para plantear algunos de los
mecanismos por los que existe el comportamiento homosexual en humanos. Por
ejemplo, aquellos estímulos que se acompañen de liberación dopaminérgica (sexo,
estrés, juego, drogas, etc) y cohabitación suficientemente prolongada pudieran
llevar a individuos adultos a desarrollar preferencias condicionadas de pareja
por el individuo con quien se cohabita en ese momento, independientemente que
sea del mismo género. Tales preferencias pueden ser sociales, y cambiar (aunque
sea temporalmente) a homosexuales dependiendo de otros factores, como la
experiencia sexual del compañero. Cabe mencionar la posibilidad de que en humanos,
la activación de receptores tipo D2 en núcleo accumbens sea necesaria para
modular el valor incentivo de la pareja potencial,26 pero no suficiente para producir
comportamiento homosexual como lo hemos observado en ratas. Como sugerimos en
nuestro continuum
comportamental, dichas preferencias de pareja homosexuales pueden ser
esporádicas o recurrentes dependiendo de la intensidad y duración del
condicionamiento, expresandose a través de comportamietos apetitivos,
precopulatorios, copulatorios o poscopulatorios.
Apoyo CONACYT 105520 a GAC-A para la realización del proyecto. Marta Miquel y Daissy Herrera por la discusión sobre el tema.
- Darwin C. El origen de las especies. Planeta agostini, Barcelona, España. 1859.
- Bagemihl B. Biological exuberance; Animal homosexuality and Natural Diversity. St Martin´s Press, First edition. 1999.
- Sommer V, Vasey P. Homosexual behavior in animals. Cambridge University Press; First edition. New York. 2006.
- Coria-Avila GA, Hernandez-Aguilar ME, Toledo-Cardenas R, Garcia-Hernandez LI, Manzo J, Pacheco P, Miquel M, Pfaus JG. Biological and neural bases of partner preferences in rodents: models to understand human pair bonds. Rev Neurol 2008 47(4):209-214.
- Coria-Avila GA, Pfaus JG, Miquel M, Pacheco P, Manzo J. Conditioned preferences induced by sex and drugs: a comparison of the neural bases. Rev Neurol 2008 46(4):213-218.
- Pfaus JG. Frank A. Beach award. Homologies of animal and human sexual behaviors. Horm Behav 1996 30(3):187-200.
- Pfaus JG, Kippin TE, Centeno S. Conditioning and sexual behavior: a review. Horm Behav 2001 40(2):291-321.
- Pfaus JG, Kippin TE, Coria-Avila G. What can animal models tell us about human sexual response? Annu Rev Sex Res 2003 14:1-63.
- Terman L, Miles CC. Sex and personality, studies in masculinity and femininity. New York: McGraw-Hill; 1936.
- Kinsey A, Pomeroy W, Martin C. Sexual behavior in the human male. Philadelphia & London: Saunders Company; 1948.
- Seidman SN, Rieder RO. A review of sexual behavior in the United States. Am J Psychiatry 1994 151(3):330-341.
- Paul T, Schiffer B, Zwarg T, Kruger TH, Karama S, Schedlowski M, Forsting M, Gizewski ER. Brain response to visual sexual stimuli in heterosexual and homosexual males. Hum Brain Mapp 2008 29(6):726-735.
- Gorski RA. Sexual differentiation of the brain. Hosp Pract 1978 13(10):55-62.
- Davis EC, Shryne JE, Gorski RA. A revised critical period for the sexual differentiation of the sexually dimorphic nucleus of the preoptic area in the rat. Neuroendocrinology 1995 62(6):579-585.
- Perakis A, Stylianopoulou F. Effects of a prenatal androgen peak on rat brain sexual differentiation. J Endocrinol 1986 108(2):281-285.
- Gorski RA. Sexual differenciation of the nervous system. En: Kandel ER, Jessell TM (Ed.) Principles of Neural Science. Mc Graw Hill. 2000 pp 1131-1148.
- Matsumoto A, Arai Y. Effect of androgen on sexual differentiation of synaptic organization in the hypothalamic arcuate nucleus: an ontogenetic study. Neuroendocrinology 1981 33(3):166-169.
- LeVay S. A difference in hypothalamic structure between heterosexual and homosexual men. Science 1991 253(5023):1034-1037.
- yne W, Tobet S, Mattiace LA, Lasco MS, Kemether E, Edgar MA, Morgello S, Buchsbaum MS, Jones LB. The interstitial nuclei of the human anterior hypothalamus: an investigation of variation with sex, sexual orientation, and HIV status. Horm Behav 2001 40(2):86-92.
- Swaab DF, Gooren LJ, Hofman MA. Brain research, gender and sexual orientation. J Homosex 1995 28(3-4):283-301.
- Allen LS, Gorski RA. Sexual dimorphism of the anterior commissure and massa intermedia of the human brain. J Comp Neurol 1991 312(1):97-104.
- Savic I, Berglund H, Lindstrom P. Brain response to putative pheromones in homosexual men. Proc Natl Acad Sci U S A 2005 102(20):7356-7361.
- Paredes RG. Medial preoptic area/anterior hypothalamus and sexual motivation. Scand J Psychol 2003 44(3):203-212.
- Hu SH, Wei N, Wang QD, Yan LQ, Wei EQ, Zhang MM, Hu JB, Huang ML, Zhou WH, Xu Y. Patterns of brain activation during visually evoked sexual arousal differ between homosexual and heterosexual men. AJNR Am J Neuroradiol 2008 29(10):1890-1896.
- Karama S, Lecours AR, Leroux JM, Bourgouin P, Beaudoin G, Joubert S, Beauregard M. Areas of brain activation in males and females during viewing of erotic film excerpts. Hum Brain Mapp 2002 16(1):1-13.
- Safron A, Barch B, Bailey JM, Gitelman DR, Parrish TB, Reber PJ. Neural correlates of sexual arousal in homosexual and heterosexual men. Behav Neurosci 2007 121(2):237-248.
- Wicker B, Keysers C, Plailly J, Royet JP, Gallese V, Rizzolatti G. Both of us disgusted in My insula: the common neural basis of seeing and feeling disgust. Neuron 2003 40(3):655-664.
- Ponseti J, Granert O, Jansen O, Wolff S, Mehdorn H, Bosinski H, Siebner H. Assessment of sexual orientation using the hemodynamic brain response to visual sexual stimuli. J Sex Med 2009 6(6):1628-1634.
- Hannula DE, Simons DJ, Cohen NJ. Imaging implicit perception: promise and pitfalls. Nat Rev Neurosci 2005 6(3):247-255.
- Lledo PM, Gheusi G, Vincent JD. Information processing in the mammalian olfactory system. Physiol Rev 2005 85(1):281-317.
- Kippin TE, Pfaus JG. The development of olfactory conditioned ejaculatory preferences in the male rat. I. Nature of the unconditioned stimulus. Physiol Behav 2001 73(4):457-469.
- Coria-Avila GA, Jones SL, Solomon CE, Gavrila AM, Jordan GJ, Pfaus JG. Conditioned partner preference in female rats for strain of male. Physiol Behav 2006 88(4-5):529-537.
- Coria-Avila GA, Ouimet AJ, Pacheco P, Manzo J, Pfaus JG. Olfactory conditioned partner preference in the female rat. Behav Neurosci 2005 119(3):716-725.
- Williams JR, Catania KC, Carter CS. Development of partner preferences in female prairie voles (Microtus ochrogaster): the role of social and sexual experience. Horm Behav 1992 26(3):339-349.
- Carter CS, Williams JR, Witt DM, Insel TR. Oxytocin and social bonding. Ann N Y Acad Sci 1992 652:204-211.
- Wang Z, Aragona BJ. Neurochemical regulation of pair bonding in male prairie voles. Physiol Behav 2004 83(2):319-328.
- Coria-Avila GA, Triana Del Rio R, Montero-Dominguez FA, Hernandez ME, Manzo J. Olfactory conditioned partner preference between male rats is induced by the D2-like specific agonist quinpirole. En: Annual Meeting of the Society for Neuroscience. Chicago, Il. 2009.
- Triana-Del Rio R, Cibrian-Llanderal IT, Tecamachaltzi-Silvaran M, Montero-Domínguez F, Garcia LI, Manzo J, Hernandez ME, Coria-Avila GA. Conditioning same-sex partner preference in male rats. Behav Neurosci 2011, enviado.
- Triana-Del Rio R, Montero-Domínguez F, Cibrian-Llanderal IT, Tecamchaltzi-Silvarán M, Manzo J, Coria-Avila GA. Erecciones sin contacto y actividad neural en un modelo de ratas con preferencia homosexual condicionada. En: Congreso anual de la sociedad mexicana de ciencias fisiológicas. Villahermosa Tabasco. SMCF; 2010.
- Aragona BJ, Liu Y, Yu YJ, Curtis JT, Detwiler JM, Insel TR, Wang Z. Nucleus accumbens dopamine differentially mediates the formation and maintenance of monogamous pair bonds. Nat Neurosci 2006 9(1):133-139.
- Diamond M, Sigmundson HK. Sex reassignment at birth. Long-term review and clinical implications. Arch Pediatr Adolesc Med 1997 151(3):298-304.
|
Recibido: 27 de
enero de 2011
|
Aceptado: 11 de
febrero de 2011
|
Correspondencia: Dr. Genaro A. Coria-Avila, Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver., Tel.: (228) 841-8900 Ext. 13609, Correo: gcoria@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la
licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0),
que permite el uso no comercial, distribución y reproducción en algún medio,
siempre que la obra original sea debidamente citada.
Fuente:https://www.uv.mx/eneurobiologia/vols/2010/2/Coria-Avila-1%282%29/HTML.html
No hay comentarios :
Publicar un comentario